蛋白质检测方法(蛋白质浓度测定常用的三种方法),蛋白质浓度计算公式
蛋白质检测方法(蛋白质浓度测定常用的三种方法)蛋白质检测方法(三种常用的蛋白质浓度测定方法),测定蛋白质浓度的方法很多,如紫外吸收法、缩二脲法、BCA法、劳里法、考马斯亮蓝法、凯氏定氮法等。目前,本文采用紫外、BCA、考马斯亮蓝三种方法,并详细介绍了这三种方法的原理、优缺点、操作及注意事项。
蛋白质检测方法(蛋白质浓度测定常用的三种方法)
紫外线法
这种方法是在280纳米波长下直接测试蛋白质。选择Warburg公式,光度计可以直接显示样品的浓度,或者选择相应的换算方法将吸光度值换算成样品的浓度。蛋白质测定的过程非常简单。先测试空白溶液,然后直接测试蛋白质。所以结果很不稳定。直接蛋白质定量法适用于检测成分相对单一的较纯蛋白质。与比色法相比,紫外直接定量法快速、操作简单;但是容易受到平行物质的干扰,比如DNA此外,灵敏度低,蛋白质浓度高。
(1)简单经验公式蛋白质浓度(毫克/毫升)=[1.45 * od280-0.74 * od260] *稀释系数
(2)通过计算OD280/OD260的比值进行精确计算,然后查表得到修正系数f,再通过以下公式计算出最终结果:
蛋白质浓度(毫克/毫升)=氟*(1/天)*外径280 *天
其中d为测量OD值的比色杯厚度
d是溶液的稀释倍数
BCA方法
原理BCA(bichinchoninic acid)与二价铜离子的硫酸铜等其他试剂混合成为苹果绿,即BCA工作试剂。在碱性条件下,当BCA与蛋白质结合时,蛋白质将Cu2还原为Cu,工作试剂由原来的苹果绿变为紫色络合物。在562纳米处,光吸收强度与蛋白质浓度成正比。
BCA蛋白浓度测定试剂盒和艾博金蛋白定量试剂盒(BCA法)提供了一种简单、快速且与去污剂相容的方法来准确定量总蛋白。
成分试剂A100毫升试剂B2毫升标准蛋白1毫升2 2.1毫克/毫升
贮藏条件和运输温度:室温(标准蛋白在4 ~ 8运输)
储存温度:室温(标准蛋白质储存在-20)
生效日期:12个月
使用方法
方法1: 96孔板
1.BCA工作液的配制:根据标准品和样品的数量,按50体积的试剂a和1体积的试剂B配制适量的BCA工作液.混好。
2.将0 L、1 L、2 L、4 L、6 L、8 L、10 L蛋白质标准品加入96孔板的蛋白质标准品孔中。加入灭菌的双蒸水至10微升.取10 L待测样品,加到96孔板的样品孔中。每次测定应平行2 ~ 3次。
3.将200 L BCA工作液(即样品与工作液的体积比为13,336,020)加入待测样品孔和蛋白质标准孔中,混合均匀。
4.37水浴30分钟。冷却至室温。
5.吸光度用562纳米的微孔板读数器测量。
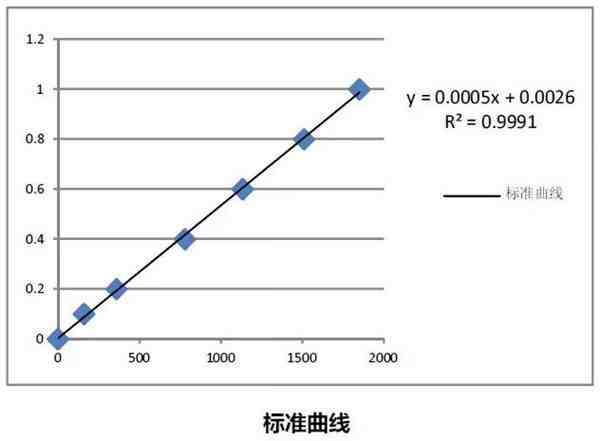
6.制作标准曲线。从标准曲线计算样品浓度。
测定蛋白质浓度的三种常用方法(详细说明)
方法2:试管法
1.工作液的配制:根据标准品和样品的数量,按50倍体积的试剂a和1倍体积的试剂b配制适量的BCA工作液,充分混合均匀。工作溶液的量应与用于测定的比色杯相对应。每次测定应平行2 ~ 3次。这里列出的比色系统使用0.5毫升比色杯。如果比色皿的规格不同,则需要将系统扩大到实验中准确读取比色皿所需的体积。
2.BSA标准品和样品的制备:样品用水或其他不干扰显色反应的缓冲溶液制备,使待测浓度位于标准曲线的线性部分。为每个反应准备了三个平行的分析。标准曲线一般有5~6点。根据样品的估计浓度确定各点的具体浓度。牛血清白蛋白可以用水或与样品一致的溶液稀释。如果待测样品的浓度约为200微克/毫升,可按下列顺序加入牛血清白蛋白标准品、样品和BCA工作溶液。
3.取适量标准蛋白,按蛋白液与工作液的比例=1:20混合均匀。37温水浴30分钟。冷却至室温。
4.测量样品和标准品在562纳米处的吸光度。
测定蛋白质浓度的三种常用方法(详细说明)
考马斯亮蓝法
实验原理考马斯亮蓝法是一种基于蛋白质-染料结合原理的快速、灵敏的微量蛋白质浓度定量方法。这种蛋白质测定方法比其他方法具有突出的优势,因此得到了广泛的应用。该方法是目前最灵敏的蛋白质测定方法之一。
考马斯亮蓝G-250染料在酸性溶液中与蛋白质结合,使染料最大吸收峰(lmax)的位置由465 nm变为595 nm,溶液颜色由棕黑色变为蓝色。通过测量595纳米处光吸收的增加,可以知道与其结合的蛋白质的量。发现染料主要与蛋白质中的碱性氨基酸(尤其是精氨酸)和芳香族氨基酸残基结合。
突出优点:(1)灵敏度高,估计比Lowry法高4倍左右,其最低蛋白质检测量可达1 mg。这是因为蛋白质和染料结合后颜色变化较大,蛋白质-染料复合物的消光系数较高,所以吸光值随蛋白质浓度的变化远大于Lowry法。
(2)测定快速简单,只需一种试剂。完成一个样品的测定只需要5分钟左右。由于染料与蛋白质的结合过程,约2分钟即可完成,1小时内颜色可保持稳定,5分钟至20分钟之间颜色稳定性最好。所以完全没有必要像劳里法那样花时间,严格控制时间。
(3)干扰物质少。如K、Na、Mg2、Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等干扰洛瑞法,不干扰本测定方法。
缺点(1)由于各种蛋白质中精氨酸和芳香族氨基酸的含量不同,考马斯亮蓝染色法对不同蛋白质的测定存在较大偏差。通常选择g-球蛋白作为制作标准曲线中的标准蛋白质,以减少这方面的偏差。
(2)仍有一些物质干扰该方法的测定。主要干扰物质有洗涤剂、Triton X-100、十二烷基硫酸钠(SDS)等。
试剂和设备1。考马斯亮蓝试剂:
将100毫克考马斯亮蓝g-250溶于50毫升95%乙醇中,加入100毫升85%磷酸,用蒸馏水稀释至1000毫升。
2.标准和测试蛋白质溶液(1)标准蛋白质溶液
将牛血清白蛋白结晶,预先用微量凯氏定氮法测定蛋白质氮含量,根据纯度用0.15 mol/L NaCl配制1 mg/mL蛋白质溶液。
(2)待测蛋白质溶液。使用前,人血清用0.15摩尔/升氯化钠稀释200倍。
3.设备试管1.515 cm(6),试管架和移液管0.5mL(2);1毫升(2);5mL(1);恒温水浴;分光光度计。
操作方法1。从制作标准曲线上取7个试管,按照下表并行操作。
摇匀,以0号试管为空白对照,在1小时内比较595 nm处的颜色。
绘制标准曲线:以A595 nm为纵坐标,标准蛋白质含量为横坐标,在坐标纸上绘制标准曲线。
二、未知样品蛋白质浓度的测定方法同上,取适当的未知样品体积,使其测量值在标准曲线的直线范围内。根据测得的A595 nm值,在标准曲线上发现相当于标准蛋白质的量,并且蛋白质浓度
注(1)添加试剂后,在5-20分钟内测量光吸收,因为在此期间颜色最稳定。
(2)测定过程中,蛋白质-染料复合物的一小部分会吸附在比色杯壁上。测定后,可用乙醇洗涤蓝色比色杯。
(3)用考马斯亮蓝法分析蛋白质必须掌握分光光度计的正确使用。重复测量吸光度时,比色杯必须清洗干净。制作蛋白标准曲线时,最好从低浓度到高浓度测量蛋白标准,以防误差。
特别声明:以上内容来自编辑、整理、发布。如有不妥,请联系我们删除。
频道精选
- 谢依霖挺二胎孕肚拍杂志 直言...2020-06-14
- 2020年经典520祝福语,520表白句...2020-06-14
- 张纪中劲歌热舞左摇右摆怎么...2020-06-14
- 权健连收3张罚单 总计罚款5...2020-06-14
- 菲律宾台风泥石流 至少31人被...2020-06-14
- 1999年「连杀八女事件」北京建...2020-06-01
- 上海隔离新政策,这些人都要...2020-05-29
- 俞强声的叛逃和结局 ,俞强声...2020-07-23
- 女逃犯劳荣枝在厦的一段视频...2020-06-12
- 恩施公安局长情色日记幕后...2020-05-30


